长期以来,中国科学院昆明植物研究所郝小江研究组以我国西部地区药用植物为研究对象,开展新颖结构天然产物的分离、结构测试、化学修饰与合成以及重要生物功能的研究,已发现70余个新骨架和1500余个新化合物。自2004年起,一直致力于与我国生物学家的合作,通过优势互补的模式,开展基于天然小分子探针的化学生物学研究,并取得若干创新性成果,先后发表在Nature Chemical Biology、Cell Research、Journal of Biological Chemistry 等学术期刊上。
日前,郝小江研究组与中国科学院遗传与发育生物学研究所杨崇林实验室合作,在 Nature Cell Biology以长文(Article)形式在线发表题为 “PKC controls lysosome biogenesis independently of mTORC1”(http://www.nature.com/ncb/journal/vaop/ncurrent/full/ncb3407.html)的研究论文。该论文从化学生物学的角度,首次揭示了在正常营养供给状态下,细胞如何应对内、外界信号,从而调控溶酶体发生和稳态平衡的新机制。
该研究以溶酶体生成的筛选体系为基础,经过大量筛选(1056个化合物),从植物天然产物中发现了以HEP14和HEP15为代表的一类巨大戟烷型二萜类活性化合物(图1)。研究发现,该类化合物能在细胞正常营养状态下,通过不依赖于mTOR的方式选择性地激活溶酶体的转录因子TFEB, 促进溶酶体生成。之后,研究人员通过分离和合成方式,构建化合物库,开展了该类化合物的构效关系研究。并在此基础上,合成了天然产物分子探针(图2),通过生物正交实验,首次揭示了该类化合物直接激活蛋白激酶C (PKC)家族的成员 PKCa和PKCd,导致蛋白激酶GSK3b的磷酸化,使之失活。该研究表明, GSK3b可以直接磷酸化TFEB的134位和138位的丝氨酸,使TFEB处于非活化状态,抑制溶酶体的生成。因此,PKC激活引发的GSK3b失活可以诱导TFEB入核而激活,从而促进溶酶体的发生。另一方面,该研究还发现PKCd的激活可以使溶酶体相关基因的抑制因子ZKSCAN3从细胞核中移位到细胞质中而失活,从而解除其对溶酶体生成的抑制(图3左)。这一作用主要源于PKCd激活导致的蛋白激酶JNK和p38的激活,它们可以使ZKSCAN3的153位苏氨酸发生磷酸化,引发ZKSCAN3的核-质移位。因此,PKC作为一个主控开关,控制两条平行的信号通路,分别激活溶酶体相关基因的转录因子TFEB和失活转录抑制因子ZKSCAN3,从而促进溶酶体的发生(图3右)。有趣的是,一个小分子探针同时干预正调控溶酶体发生的两条平行的信号通路,显示了天然产物的魅力所在。
由于许多细胞外信号(如生长因子、激素、趋化因子、神经递质、病原侵染等)可以与细胞膜上的受体(如RTK,、GPCR和TLR等)结合,产生第二信使二酰甘油(DAG)而激活PKC。因此PKC介导的溶酶体生成是细胞在响应外界信号时产生溶酶体适应 (lysosomal adaptation)的一种重要调控机制。
该研究还发现,在细胞模型中,激活PKC的二萜类化合物HEP14通过依赖于溶酶体的方式促进脂滴和变性蛋白聚集体的清除。在阿尔茨海默疾病的APP/PS1小鼠模型中,腹腔注射HEP14可显著减少小鼠脑部淀粉样蛋白沉积斑块的累积。研究表明这一效应依赖于PKC的激活。这些结果提示PKC的激活剂可能成为治疗溶酶体贮积病及神经退行性疾病的潜在药物。
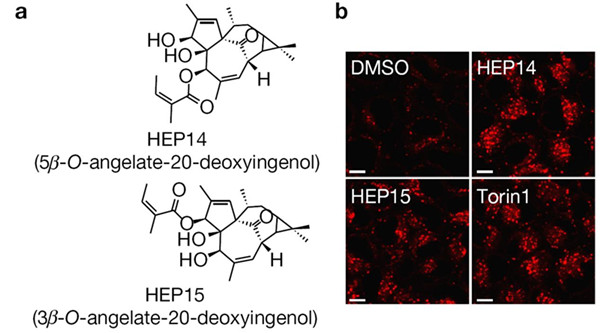
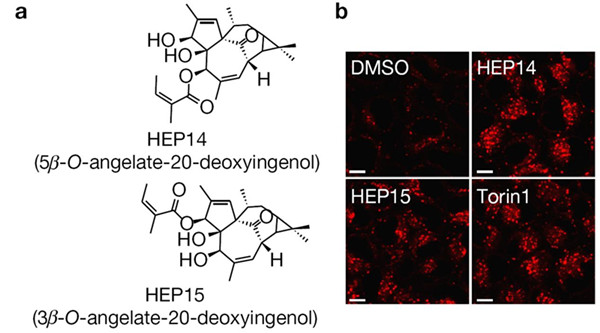
图1 HEP14和HEP15结构及其促进溶酶体的生成
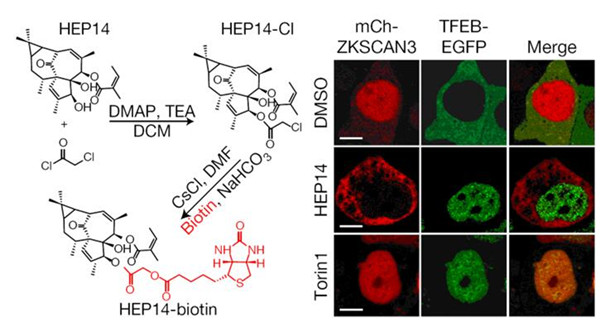
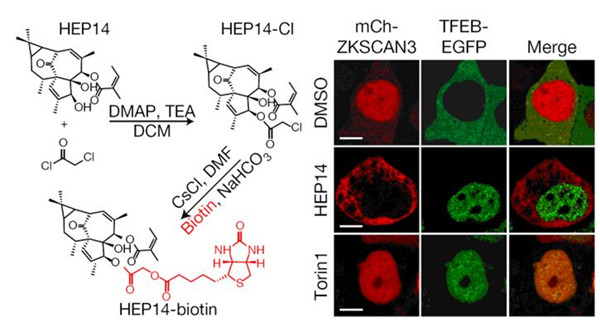
图2 HEP14分子探针的合成及其功能:可诱导TFEB-EGFP从细胞质向细胞核转移,同时mCherry-ZKSCAN3从细胞核向细胞质转移
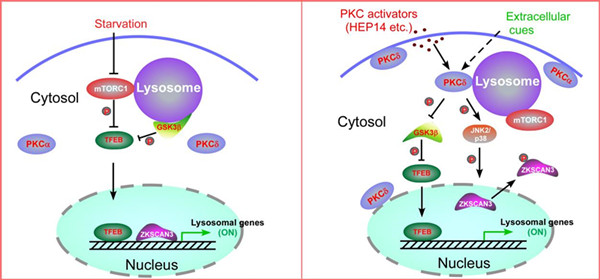
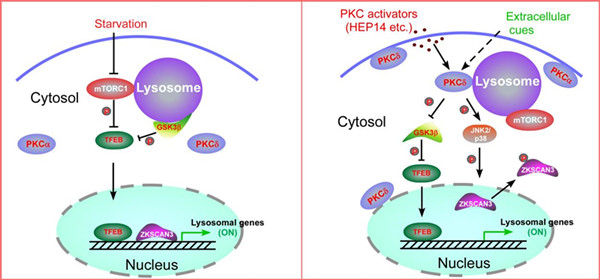
图3 饥饿诱导的溶酶体发生机制(左)和PKC介导的溶酶体发生机制(右)的比较